自達爾文時代以來�����,生物學家一直關注一個重要問題——生物是如何從共同的祖先演化成為豐富多樣的物種的����?新基因的產生是生物演化和物種多樣性形成的重要源泉�����。研究新基因的起源機制實質上是在探究生命演化的根源����,但在分子水平上�,新基因是如何被保留下來的、又是如何整合到已有的網絡通路中的�����、對生物的適應性演化做出了什么貢獻���,仍未得到較好的研究��。
中國科學院水生生物研究所魚類系統學與生物地理學學科組通過比較分析魚類的基因組��,在模式生物斑馬魚中鑒定到一個新的嵌合基因(chiron),首次系統研究了新基因的起源����、演化���、表達模式��、分子功能及信號通路的整合過程,并進一步探討了鯉科魚丹亞科(Danoninae)魚類在東南亞水生環境中產生廣泛適應性進化的分子機制���。
大約在4800至5400萬年前的魚丹亞科魚類中,一個高度保守的管家基因——煙酰胺磷酸核糖轉移酶(Nicotinamide phosphoribosy transferase, NAMPT)經過反轉座的過程形成了CDNA����,并插入到基因組中的其他位置�,通過在其上游區域招募到一段蛋白編碼序列����,形成一個新的嵌合蛋白基因,稱之為祖先的chiron基因�����。大約在100至400萬年前�����,chiron基因通過革新-擴增-分化(Innovation-Amplification-Divergence (IAD))模式��,特異性地在斑馬魚中產生了5個重復拷貝(chiron1-5)?�;虮磉_數據證明�����,chrion基因可能起源于胚胎早期發育過程中�����,隨著功能演化,其表達部位逐漸延伸到精巢中��。細胞實驗證明了chrion蛋白具有NAD+限速酶的功能�����,能夠有效提升細胞中NAD+的水平。通過Morpholino敲降和CRISPR-Cas9基因編輯技術,研究人員證明了chiron是斑馬魚胚胎發育的必需基因�,該結果為魚類新基因的功能研究增添了新證據(圖1)�����。
進一步研究發現,新基因chiron通過直接催化NAD+的限速反應��,整合到古老的核心網絡NAD+合成通路中����,并促進該信號通路中的兩個能量代謝基因——nmnat1和naprt在魚類中發生正向選擇,從而系統性地驅動整個NAD+生物合成通路的協同演化(圖2)���。
NAD+是一種重要的輔助因子,在新陳代謝的過程中發揮重要作用。在能量緊缺時(如缺糖����、禁食����、限制熱量和運動)���,NAD+的表達水平會顯著增加�����。因此�����,通過調節NAD+的水平,chiron基因可能起到一種重要的生理穩態機制的作用����,通過持續性地維持細胞中的NAD+水平����,確保NAD+的充足性���,進一步提高魚丹亞科群體對不同生態環境的適應能力�����,尤其是在食物短缺和能量匱乏的關鍵時期�。此外��,已有研究表明�,提高NAD+能夠延緩哺乳動物的衰老和延長壽命�����。那么�,利用新基因chiron對整個NAD+合成途徑(nmnat1和naprt)進行系統性地改善�����,為提高細胞的NAD+水平提供了新思路��,可能進一步推動人類的抗衰老和延長壽命等生物醫學領域的研究。
相關研究成果以The new chimeric chiron genes evolved essential roles in zebrafish embryonic development by regulating NAD+ levels為題��,在線發表在Science China Life Sciences上�����。該研究由博士方成池等完成,水生所為第一完成單位����,水生所研究員何舜平為論文通訊作者���,研究工作得到中科院戰略性先導科技專項(B類)��、國家自然科學基金委員會重大研究計劃、國家自然科學基金青年基金等項目的資助����。此外��,該研究還獲得演化領域學者的關注,芝加哥大學生態與演化系教授龍漫遠發表評論�����,該評論以A zebrafish-specific chimeric gene evolved essential developmental functions: discussion of conceptual significance為題���,發表在Science China Life Sciences上����。
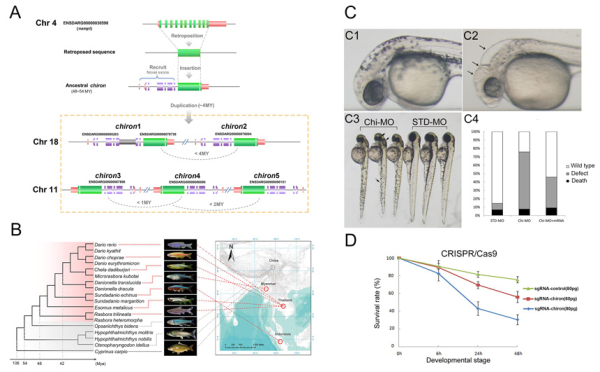
圖1.新基因chiron的起源和功能
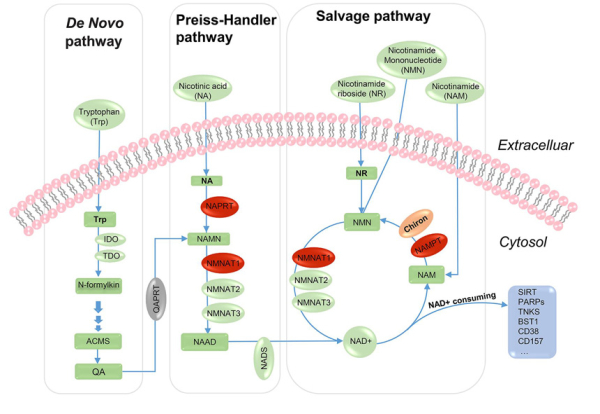
圖2.新基因chiron促進NAD+合成通路的協同演化